-
题目: 未知类型
钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿t,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算: (1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g
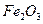 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到
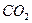 气体
气体224mL。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00mL相同浓度的
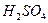 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示:
计算硫酸溶液的物质的量浓度。实验序号 I Ⅱ Ⅲ 加入钢样粉末的质量/g 2.812 5.624 8.436 生成气体的体积/L(标准状况) 1.120 2.240 2.800 ③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
答案不对?请尝试站内搜索
推荐知识点:
- 没有买卖就没有杀害。据统计,目前每年约有3万头非洲大象因非法象牙交易被盗猎者杀害。为警示非法象牙交易,多国政府公开销毁缴获的象牙及其制品。材料表明() ①减少象牙消费将减少猎杀行为 ②非法猎杀导致象牙的非法交易 ③公开销毁象牙可以减少象牙交易 ④象牙消费增长源于收入水平提高
- 矿石的湿度不影响粗破机的生产率。
- 下面哪项不是脑外伤常见的并发症()
- 某市卷烟厂为增值税一般纳税人,职工人数年均70人,资产总额2500万元。 2017年度有关生产经营情况为: (1)年初库存外购已税烟丝10吨,每吨单价0.8万元,共计金额8万元;当年内又购进已税烟丝50吨,每吨不含税单价0.8万元,取得销售方开具的增值税专用发票,以银行存款支付购货金额40万元、增值税额6.8万元,烟丝全部验收入库;采购烟丝过程中另以银行存款合计支付运输费用2万元,取得运输单位开具的增值税专用发票。 (2)当年生产领用烟丝45万元;销售120标准箱卷烟给某大型商场,向购买方开具了增值税专用发票,取得销售金额300万元,增值税额51万元;直接销售8标准箱卷烟给使用单位和消费者个人,开具普通发票,取得销售收入23.4万元。 (3)当年卷烟销售成本共计为80万元;财务费用5万元。 (4)发生管理费用8万元(管理费用中含业务招待费4万元)。 (5)销售费用10万元(含广告费8万元)。 (6)计人成本、费用的实发工资费用150万元和计提的三项经费37.5万元。三项经费具体情况如下:计提工会经费3万元,已取得专用收据;计提福利费30万元,实际发生28万元;计提教育经费4.5万元,实际发生3万元。 (7)营业外支出20万元,其中被工商部门行政罚款6万元,向本厂困难职工直接捐赠4万元,通过民政部门向某贫困地区捐赠10万元。 (8)“投资收益”科目记载有来源于境内全资子公司投资收益27万元(子公司适用企业所得税税率为25%)。 (9)2016年度尚有未弥补的亏损19.61万元。 (其他相关资料:烟丝消费税税率30%;卷烟消费税税率56%,每标准箱定额征收消费税150元) 要求:根据上述资料,计算并回答下列问题。 计算本年度应缴纳的城建税、教育费附加和地方教育附加。
- 需求拉上型通货膨胀的成因主要是()
- 属于尺骨的结构是()
- 人民法院受理债务人甲公司破产申请时,乙公司依照其与甲公司之间的买卖合同已向买受人家公司发运了该合同项下的货物,但甲公司尚未付价款。乙公司得知甲公司破产申请被受理后,立即通过传真向甲公司的管理人要求取回在运途中的货物。管理人收到乙公司传真后不久,即收到了乙公司发运的货物。下列表述中,正确的是()
- 在一个宏的操作序列中,如果既包含带条件的操作,又包含无条件的操作。则带条件的操作是否执行取决于条件式的真假,而没有指定条件的操作则会( )。
- 下列哪项不是霍利保持器的组成部分()
- 一螺纹的标记为M10LH-6H,该螺纹是外螺纹。