-
题目: 问答题
案例:
下面是两位中学教师关于"原电池"的教学过程实录
【李老师的教学实录】
【课堂引入】你曾亲身体验趣味实验的神奇吗?你有积极参与趣味实验的兴趣吗?那么请你来亲身体验吧。
【学生】学生用舌尖感受水果电池的电流。
【老师提问】你有什么感觉吗,你的观点是什么呢?
【学生回答】有麻麻的感觉,好像有电。
【课堂投影】1780年意大利解剖学家伽伐尼在做青蛙解剖实验,引导学生做如下实验。
第一步:把一块锌片和铜片分别插入盛有稀硫酸的烧杯里。
第二步:用导线将锌片和铜片连接起来。
第三步:在导线中接入一个灵敏电流计。
【老师】在实验过程中,老师引导学生仔细观察每一个步骤,善于提问、善于分析总结,在实验的过程中学生提出了一系列的问题:
(1)电流表为什么偏向铜?
(2)导线连起来后为什么铜极上有气泡?
(3)电极移动为什么电流表会有变化?……
【课堂投影】利用flash动画向学生展示原电池工作的微观机理。
【得出结论】原电池形成的实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。
【课堂过渡】明白了原电池工作原理,但是原电池形成条件又是怎样呢?
【学生实验】组建四个小组,分别探究原电池形成条件。
【实验结论】四个小组经过认真的实验和分析,通过讨论交流,最终得出原电池形成的条件。
【王老师的教学实录】
【视频】播放水果电池充电
【提问1】这个视频你看到了什么?我们知道化学反应一般都伴随着能量的产生,有的转化为热能,有的转化为光能,这个过程中能量是如何进行转换的呢?
【板书】一、原电池的定义:将化学能转化为电能的装置。
【过渡】原电池究竟是如何将化学能转化为电能的呢?今天让我们走上科学的探索之路,首先我们来看一组实验。
【实验】我们一起看以下四组实验现象:第一个实验是将锌片放入硫酸溶液中;第二个实验是将铜片放入硫酸溶液;第三个实验是将锌片和铜片平行插入硫酸溶液中;第四个实验是将锌片和铜片接触放入硫酸溶液中。
【学生】观察实验现象。
【设问】大家就各个实验现象进行解释。
【生1】第一个实验锌片放入硫酸溶液中有气泡产生,是因为锌与硫酸发生置换反应,生成了氢气。
【生2】第二个实验铜片放入硫酸溶液无气泡产生,是因为铜不活泼,不能置换出氢气。
【生3】第三个实验锌片和铜片平行插入硫酸溶液中锌片上有气泡产生,铜片上没有气泡产生,是因为锌与硫酸发生置换反应,生成的氢气,铜不活泼,不能置换出氢气。
【生4】第四个实验是将锌片和铜片接触放入硫酸溶液中,铜片上有气泡产生,锌片上没有气泡产生,应该是铜与硫酸发生置换反应。
【生5】如果可能是铜与硫酸反应,那么实验中有Cu2+,溶液应该变为蓝色,但是实验中溶液没有变成蓝色,所以应该是锌与硫酸发生反应。
【老师】学生对前三个实验解释的很正确,那么对于第四个实验,有学生说是锌与硫酸发生反应,那么为什么在铜片上产生了气泡,而不是在锌片。
【学生讨论】因为锌把电子转移到铜片上。
【提问】电子从何而来?电子是从溶液传递还是锌片与铜片的接触点传递的呢?
【回答】是接触点传递的,如果是溶液传递的,电子应该可以传递到铜的表面的,第三个实验应该铜片表面会产生气泡。
【讲述】如果有电子的移动就应该会有电流,那电流是如何产生的呢?
【过渡】下面我们通过实验来验证:将锌片和铜片用导线连接起来,在导线之间接入灯泡。平行插入稀硫酸溶液中观察实验现象。(注意观察铜片表面的变化)我们一起来分析一下电流的产生原理。
【多媒体展示】Cu-Zn原电池闭合状态下微观粒子运动的动画模拟与实验4相似,并展示
Cu片、Zn片上得失电子的反应式。
【讲述】在这个装置中锌片失去电子、失去的电子通过导线传递给铜片,溶液中的H+在铜片的表面得到电子变成氢气,该装置发生了化学反应在外电路产生了电流,电子由Zn片流出,产生了电能
【过渡】原电池的组成部分有哪些?那么原电池的形成条件是怎样的呢?(改变实验的一个因子)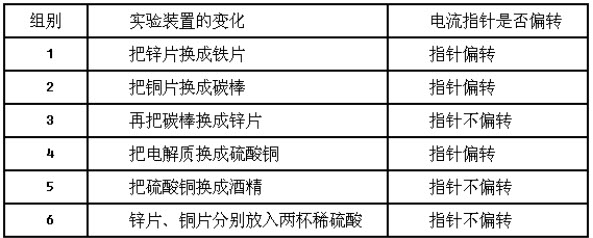
【引导】让学生认识到实验中三个变量之间的关系:①电极材料:同种电极与不同种电极;②电解质溶液:电解质与非电解质;③通络:闭合回路的形成。暗示以此确定设计实验的探究方向。
【讲解】上面,我们通过实验探究了原电池的工作原理,初步形成原电池的概念,那么,原电池是由哪些部分组成的?也即原电池的构成条件是什么?
【探究一】电极的探究
【探究二】电路的探究
【学生活动】学生分组总结汇报实验结果和实验结论,师生共同交流探讨,得出结论
【板书】略。
问题:
(1)根据两位老师的教学过程,说明所用教学方法都有哪些,并指出他们教学过程中的某个亮点。
(2)以李老师的教学为例,说明好的化学课程导入的要求是什么?
(3)根据上述教学实例,归纳总结出化学课堂中实验探究的基本教学思路。答案不对?请尝试站内搜索