-
题目: 未知类型
Ⅰ:利用水煤气合成二甲醚的三步反应如下: ①2H
 (g)+CO(g)
(g)+CO(g)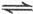 CH
CH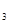 OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol
②2CH
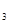 OH(g)
OH(g)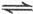 CH
CH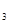 OCH
OCH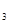 (g)+H
(g)+H O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol
③CO(g)+H
 O (g)
O (g)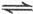 CO
CO (g)+H
(g)+H (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol
总反应:3H
 (g)+3CO(g)
(g)+3CO(g)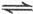 CH
CH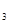 OCH
OCH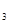 (g)+CO
(g)+CO (g)的ΔH=__________:
(g)的ΔH=__________:Ⅱ:如图甲、乙是电化学实验装置。

(1)若甲、乙两烧杯中均盛有饱和NaCI溶液。
①甲中石墨棒上的电极反应式__________,电子的移动方向为________;
②乙中总反应的离子方程式为__________,Cl
 移向__________电极(填Fe或C);
移向__________电极(填Fe或C);③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl
 氧化了生成的I
氧化了生成的I 。若反应中Cl
。若反应中Cl 和I
和I 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;(2)若甲、乙两烧杯中均盛有CuSO
 溶液。
溶液。①甲中铁棒上的电极反应式为:______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO
 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。答案不对?请尝试站内搜索
推荐知识点:
- 在诚信考核中,未配合汽车客运站执行车辆安全例行检查以及出站检查制度,擅自驾驶客车出站的,扣()分。
- 儒家学说思想核心在于___,而道家学说思想核心在于___。
- 患者恶寒发热,头疼身痛,无汗而喘,舌苔薄白,脉浮紧。治宜()
- 使用流速计测量水的流量时,将应探头放入管道或渠道的()处。测量的时间越长,所测量流速越准确,测量的时间应大于()s(H为水的深,m)
- 反映身体机能水平的静态指标评定的是()。
- 在满足工艺要求下,仪表的精确度越高越好。()
- 下列零件部品不属于安规管控部品的是().
- 突发公共卫生事件应急指挥部根据突发事件应急处理的需要,可以对以下哪些环节采取控制措施:()
- eTOM模型涵盖了电信企业管理的各个环节,下列对eTOM的理解正确的是()。
- 女,35岁,右踝前方有一绿豆大棕色肿块3年,微凸出皮肤,5个月前肿块处稍有痒感,搔破出血,近月来右腹股沟及膝内侧皮下出现肿块数个。合理的治疗方法为()