-
题目: 未知类型
Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应. (1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,______,然后研细;⑤检查④中洗涤是否完全的操作是______.
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
①从设计原理看,实验中的待测数据是______.实验序号 双氧水体积 催化剂 待测数据 a 15mL 无 b 15mL 0.5g CuO c 15mL 0.5g MnO2 ②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.______.
Ⅱ.摩尔盐[(NH4)2SO4-FeSO4-6H2O]
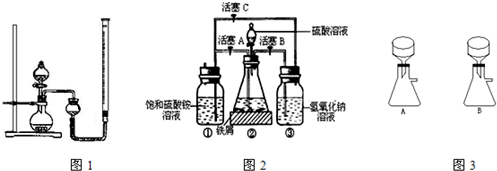
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞______,打开活塞______(填字母).向容器①中通人氢气的目的是______.
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是______.(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol-L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
+5Fe2++8H+=Mn2++5Fe3++4H2O-4 试求产品中摩尔盐的质量分数______.(NH4)2SO4-FeSO4-6H2O的相对分子质量为392.
答案不对?请尝试站内搜索