-
题目: 未知类型
工业上生产硫酸时,将SO2氧化为SO3是关键一步. (1)某温度下,2 SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= .
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 .
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
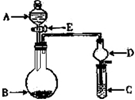
(3)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: .
(4)在0.1mol?L-1的(NH4)2SO4溶液中,离子浓度由大到小的顺序是 .
答案不对?请尝试站内搜索